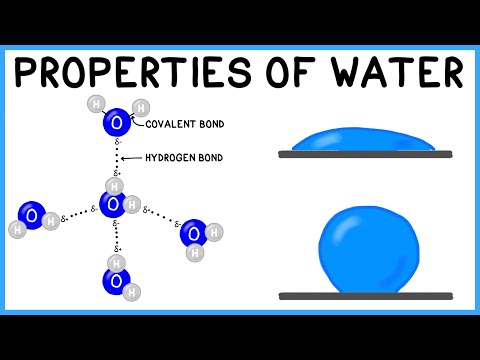
Beide chemische bestanddelen aangezien chemische elementen uit moleculen bestaan, en deze op hun beurt weer uit atomen bestaan. De atomen blijven verenigd dankzij de vorming van de zogenaamde chemische verbindingen.
De chemische bindingen zijn niet allemaal hetzelfde: in feite zijn ze afhankelijk van de elektronische kenmerken van de betrokken atomen. Er zijn twee meest voorkomende soorten koppelingen: Ionische bindingen en de covalente obligaties.
Meestal zijn covalente obligaties die houd niet-metalen atomen bij elkaar. Het komt voor dat de atomen van deze elementen veel elektronen in hun buitenste schil hebben en de neiging hebben elektronen vast te houden of te winnen, in plaats van ze op te geven.
Vandaar de manier waarop deze stoffen of chemische verbindingenico's bereiken stabiliteit door een paar elektronen te delen, uniet van elk atoom. Op deze manier is het gedeelde elektronenpaar gemeenschappelijk voor de twee atomen en houdt het ze tegelijkertijd bij elkaar. In de gassen edelen, dit gebeurt bijvoorbeeld. Ook in halogeenelementen.
Wanneer de covalente binding optreedt tussen elementen met vergelijkbare elektronegativiteit, zoals tussen waterstof en koolstof, wordt een binding gegenereerd apolair covalent. Dit gebeurt bijvoorbeeld in koolwaterstoffen.
Evenzo vormen homonucleaire moleculen (bestaande uit hetzelfde atoom) altijd apolaire bindingen. Maar als de binding ontstaat tussen elementen met verschillende elektronegativiteit, wordt in het ene atoom een hogere elektronendichtheid geproduceerd dan in het andere, waardoor een pool ontstaat.
Een derde mogelijkheid is dat twee atomen een paar elektronen delen, maar dat deze gedeelde elektronen slechts door één atoom worden bijgedragen. In dat geval spreken we van datief of gecoördineerde covalente binding.
Voor een datief link Je hebt een element nodig met een vrij elektronenpaar (zoals stikstof) en een ander dat elektron-deficiënt is (zoals waterstof). Het is ook noodzakelijk dat degene met het elektronenpaar elektronegatief genoeg is om de te delen elektronen niet te verliezen. Deze situatie doet zich bijvoorbeeld voor bij ammonium (NH4+).
De stoffen die covalente verbindingen bevatten, kunnen voorkomen in elke toestand (vast, vloeibaar of gasvormig), en in het algemeen het zijn slechte geleiders van warmte en elektriciteit.
Ze laten het vaak zien relatief lage smelt- en kookpunten Y zijn meestal oplosbaar in polaire oplosmiddelen, zoals benzeen of tetrachloorkoolstof, maar ze zijn slecht oplosbaar in water. Ze zijn extreem stabiel.
Er kunnen talloze voorbeelden worden gegeven van verbindingen of stoffen die covalente bindingen bevatten:
- Fluor
- Broom
- Jodium
- Chloor
- Zuurstof
- Water
- Kooldioxide
- Ammoniak
- Methaan
- Propaan
- Silica
- Diamant
- Grafiet
- Kwarts
- Glucose
- Paraffine
- Diesel
- Stikstof
- Helium
- Freon


